
朱平研究组与合作者揭示一种新型古菌包膜病毒的基因组结构及其感染策略
三域学说将地球上的生命分为细菌、古菌和真核生物三个生命域。其中古菌广泛分布于极端环境如高温、强酸、强碱或高盐环境中,被认为是研究生命起源和极端环境生存机制的关键对象。感染古菌的病毒被称为古菌病毒,其形态多样,如纺锤形、瓶状、水滴形、丝状、棒状等,这些病毒的发现激发了人们对古菌病毒极端环境的适应性的研究兴趣。
前期对古菌病毒的研究主要集中在结构较为均一的丝状病毒、纺锤状病毒和正二十面体病毒,它们通常依赖高度紧凑的组织结构来抵御极端环境的影响。例如丝状病毒通过其主要衣壳蛋白将基因组DNA包装为A型DNA,并可通过广泛的蛋白质间的疏水相互作用阻隔环境中极端pH的影响。然而,古菌病毒中的包膜病毒,由于其柔性较高、结构均一性低、且缺乏对称性,因此难以通过单颗粒三维重构等方法解析其结构。另外,对于古菌病毒在极端环境下侵染宿主的策略,目前仍然研究较少,且缺乏原位证据,分辨率不足。因此,深入研究古菌包膜病毒的结构特性及其极端环境适应机制,将有助于填补现有认知空白,并为极端环境下病毒-宿主的相互作用提供新见解。
2025年7月18日,中国科学院生物物理研究所朱平研究团队与南方海洋科学与工程广东省实验室(广州)/中国科学院微生物研究所黄力研究团队以及中国地质大学(北京)王海纳博士合作在《Science Advances》杂志发表了题为"Insights into the spool-like architecture and infection strategy of an enveloped archaeal virus "的研究论文,对分离自哥斯达黎加极端酸性热泉(86-106°C, pH2.2-2.5)的古菌包膜病毒Sulfolobus ellipsoid virus 1(SEV1)独特的核衣壳构架进行冷冻电镜结构解析,并首次利用冷冻聚焦离子束(Cryo-focused ion beam,cryo-FIB)减薄和冷冻电子断层成像(Cryo-electron tomography,cryo-ET)技术探索其感染策略(图1),在古菌病毒结构多样性、极端环境适应机制以及生活史研究方面取得了进展。
研究团队首先对SEV1病毒颗粒富集后进行冷冻电子断层成像数据收集。病毒的核衣壳是由核蛋白与其基因组DNA结合形成的核蛋白纤丝缠绕形成的。分析显示,病毒核蛋白纤丝在平面内沿着病毒纵轴多次环绕,形成类似于蚊香片的盘状结构,并通过多个此类结构的堆叠,形成一个紧凑的螺旋"线轴"。同时研究者发现核蛋白基因组上以"串珠"状排列,呈现出一定的规律性。随后研究者使用子断层平均(Subtomogram averaging,STA)的方法对病毒颗粒上不同区域的特征进行分析。平均结果显示核蛋白在核衣壳中以类似晶格状的方式排列,核蛋白之间的距离相对固定。病毒基因组被核蛋白包装为蚊香片式的结构,并在蚊香片的中间形成一个孔洞,随着蚊香片结构的堆叠,构成了一个贯穿整个核衣壳的通道。通过STA,研究者得到了上述特征的准确模型参数。
通过生化分析,研究者确定了SEV1编码的VP4蛋白为其主要衣壳蛋白,也即前述"串珠"状核蛋白。结合AlphaFold蛋白结构及蛋白质-DNA互作预测分析发现,VP4蛋白以二聚体形式存在,每个单体包含五个α-螺旋,二聚体通过螺旋共同形成了一个中央通道供DNA穿过。这一结构与此前报道的丝状和正二十面体型古菌病毒核衣壳蛋白的蛋白质-DNA相互作用模型一致。VP4在公共数据库中的同源序列很少,对检索到的同源序列的系统发育学分析显示,尽管它们之间的一级序列相似性较低,三级结构却高度保守,且均来自太平洋地区的极端酸热环境,包括美国黄石国家公园的热泉、日本的热泉和墨西哥加利福尼亚湾的深海沉积物。因此,研究者推测,无论病毒形态如何,其主要核衣壳蛋白α-螺旋形成二聚体包裹核酸的方式可能是古菌病毒在极端环境下保护其遗传物质的的保守策略。综合结构生物学和生物信息学分析,研究者提出了由VP4介导新型病毒包装模型--"卷曲-堆叠"模型(coil-stacking)。
除了典型的符合"卷曲-堆叠"模型的病毒颗粒,研究者还在感染的宿主细胞内以及纯化后的病毒制备物中发现含有核衣壳部分翻转的病毒颗粒,称之为"非典型病毒颗粒"。这类病毒颗粒中的蚊香片结构相对于其他部分发生了翻转,显示SEV1病毒颗粒的核衣壳结构具有柔性。虽然其核衣壳依旧保持了"卷曲-堆叠"的排布模式,但是其核蛋白纤丝非常"软",那么这种柔性的结构是如何适应极端环境的呢?研究者通过模拟不同极端条件(pH0.5-13,25-100°C)对完整病毒颗粒和病毒核衣壳结构进行处理,观察病毒及其核衣壳在极端条件下的稳定性。值得注意的是,研究者发现,在高温环境下病毒本身结构仍然能够保持完整,但是当其失去包膜后,其核衣壳结构被完全破坏,提示这种古菌病毒的包膜对于基因组的稳定性起到关键性作用。这与之前报道的古菌丝状病毒结构主要依靠刚性来抵御极端环境有所不同。
随后,研究团队利用cryo-FIB和cryo-ET对SEV1感染古菌宿主细胞的过程进行了观察,并结合分割结构分析发现:在健康的宿主细胞中,细胞质分布均匀且S-层紧密附着于细胞膜;被SEV1感染后,宿主胞质显著重组,原本均匀的细胞质逐渐凝缩成斑块状,并形成类似于"病毒工厂"的大块高密度聚集区域;研究者在这些区域周围捕捉到一系列病毒组装中间体,包括正在盘绕的核蛋白纤丝,以及被装配到带有刺突蛋白的囊膜内形成的成熟子代病毒颗粒,且可见典型的"卷曲-堆叠"核衣壳结构。这些观察显示 SEV1 的装配和获得囊膜的成熟过程均在宿主胞质内完成。这一结果表明,与许多其他已知的包膜病毒不同,古菌包膜病毒SEV1的包膜是在宿主胞质中形成而非通过出芽自宿主细胞膜获得。包装成熟的SEV1子代病毒颗粒通过在宿主细胞表面形成典型六边形金字塔结构(Virus-associated pyramids,VAPs),并通过VAPs开口释放。直到病毒感染的晚期,细胞内物质消耗殆尽,宿主细胞几乎变为空壳。
由上述结果可知,VAPs是SEV1释放的关键结构。是什么蛋白构成了VAPs?通过对病毒编码基因的二级预测和功能验证,研究者证明SEV1编码的ORF84可能是构成VAPs的相关蛋白,且能在冰岛硫化叶菌遗传操作系统(S. islandicus E233S)中经诱导产生类似的多瓣开口。有趣的是,SEV1-ORF84在天然宿主Sulfolobus sp. A20中形成六边形金字塔结构而在遗传操作系统S. islandicus E233S中则形成七边形结构,这说明宿主细胞在VAPs形成中也发挥了作用。
上述发现展示了SEV1在宿主细胞内的精细装配、囊膜获得和释放的全过程,也是首次利用cryo-FIB对古菌病毒生活史进行研究,揭示了古菌病毒在极端环境下进化出的独特的组装与释放策略。
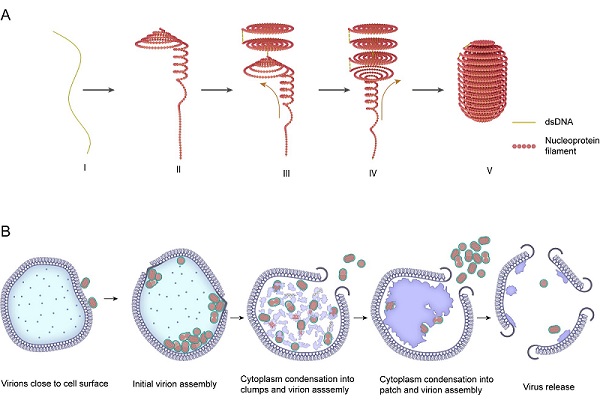
图1:SEV1病毒基因组的组装和感染过程模型
中国科学院生物物理研究所朱平研究组博士生张浩楠和中国地质大学(北京)的王海纳博士为该论文的共同第一作者,朱平研究员、黄力研究员和王海纳博士为论文的通讯作者。该研究工作得到国家自然科学基金、科技部、中国科学院、南方海洋科学与工程广东省实验室(广州)以及中国博士后科学基金等项目的资助。
文章链接:
https://www.science.org/doi/10.1126/sciadv.adv7326
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202507/t20250723_1048445.shtml
(供稿:朱平研究组)
附件下载: