
张宏研究组揭示转录因子LIN-15B调控自噬活性及溶酶体功能
自噬过程的关键步骤包括自噬体形成、自噬体与溶酶体融合以及溶酶体降解。自噬-溶酶体通路基因的转录调控是调节自噬活性的重要机制。已知哺乳动物中调控自噬-溶酶体通路基因转录的主要转录因子是TFEB,但线虫中TFEB同源物HLH-30主要参与衰老及应激条件下自噬的调控,而且hlh-30功能缺失的线虫并无明显自噬缺陷表型。因此,在线虫发育过程中是否存在其他转录调控因子来系统性调控自噬活性尚未可知。
2025年4月2日,张宏研究团队在《Autophagy》杂志发表题为"T16G12.6/IMPORTIN 13-mediated cytoplasm-to-nucleus transport of the THAP transcription factor LIN-15B controls autophagy and lysosome function in C. elegans"论文揭示IMPORTIN-13(IPO-13)通过介导转录因子LIN-15B的核质转运调控线虫自噬活性与溶酶体功能。lin-15B属于SynMuv(synthetic multivulva)B基因,参与调节线虫外阴的正常发育、细胞周期进程、幼虫生长、生殖腺发生和咽部形态发生等过程。SynMuv B基因与SynMuv A或 SynMuv C基因同时丧失功能会导致多外阴缺陷表型。然而其他Synmuv基因功能缺失并不能抑制自噬突变体表型,提示SynMuv基因lin-15B在自噬调控方面具有特异性。lin-15B含有THAP结构域,在染色体分离、染色质修饰和转录调控中发挥作用。研究发现,IPO-13是LIN-15B的核输入蛋白,负责将LIN-15B从细胞质转运到细胞核中。在生理条件下,LIN-15B主要定位在细胞核中,抑制自噬溶酶体通路相关基因的表达,维持自噬基因的低转录水平,以确保自噬处于基础生理水平。在ipo-13突变体或饥饿线虫中,LIN-15B无法正常入核,在细胞核的表达水平降低,引起自噬基因的表达上调从而增加自噬通量。
综上,该研究发现转录因子LIN-15B是调控线虫发育过程中自噬活性的关键因子,且LIN-15B的调控功能依赖于核转运蛋白IPO-13将其从细胞质运输到细胞核中,并且这一过程受营养状态调控。
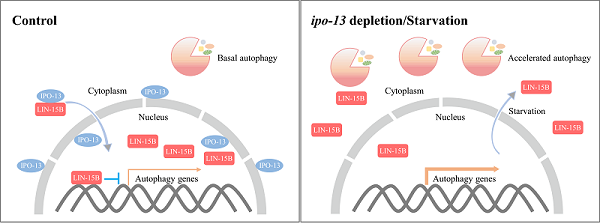
图. IPO-13通过介导LIN-15B的核质转运从而调控自噬活性的模型
中国科学院生物物理研究所张宏研究员为该论文通讯作者,中国科学院生物物理研究所助理研究员马晓丽和博士研究生缑晓萌为论文的共同第一作者。本研究得到国家自然科学基金委、中国科学院重大科学基础设施基础研究项目和新基石科学基金会的资助。
文章链接:
https://www.tandfonline.com/doi/full/10.1080/15548627.2025.2482724
(供稿:张宏研究组)
附件下载: