
胡俊杰研究组揭示冠状病毒装配的关键机制
冠状病毒的侵染对人类健康构成了重大威胁。尽管关于病毒入侵细胞、引发免疫应答等机制已有大量研究,但病毒表面的元件往往变异迅速,为广谱干预带来挑战。相比之下,其胞内感染路径由于依赖宿主细胞而更为保守,因此为广谱抗病毒策略提供了理想靶标。然而,冠状病毒的装配位点及具体方式尚不明确,且存在较大争议,亟待系统阐明。
2025年6月16日,中国科学院生物物理研究所胡俊杰研究组在《Science Bulletin》在线发表题为"An unconventional topology of betacoronavirus membrane protein drives viral assembly"的研究论文,揭示了冠状病毒膜蛋白(M)的非经典拓扑结构驱动病毒装配的分子机制,为广谱干预冠状病毒的胞内路径提供了重要的基础和新的思路。
属冠状病毒通常含有三个整合膜蛋白作为构成病毒颗粒的结构蛋白,分别为S、E和M。研究发现,新冠病毒的M蛋白虽然有三个预测的跨膜区,但其N端和C端均朝向胞浆/胞内侧,进一步分析表明,其第一个"跨膜区"并未整合到膜内,这一非经典的拓扑结构使得M蛋白的N端糖基化位点不会被修饰。与此相吻合的是, M蛋白一旦发生糖基化修饰(即出现错误朝向),就无法在胞外组分中出现,且在释放到胞外的活病毒中也很难检测到糖基化的M蛋白。这一特性在其他 属冠状病毒中也呈现保守趋势。
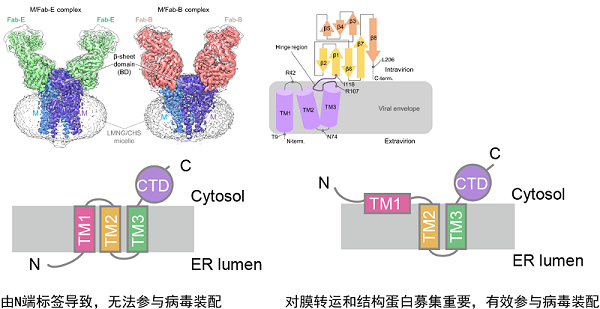
M蛋白的膜朝向
令人不解的是近期解析的多个M蛋白结构均呈现三次跨膜的拓扑构象。研究表明,M蛋白的正确朝向对N端的氨基酸组成极为敏感,而为纯化蛋白所添加的N端标签会显著增加错误朝向发生的概率。此外,在大量表达时,三次跨膜的构象稳定性会优于两次跨膜,这也使得纯化过程无形中富集了错误构象的蛋白。这一意外结果也提示,在基于纯化蛋白的膜蛋白结构解析中,应慎重判断其内源情况下的膜朝向。
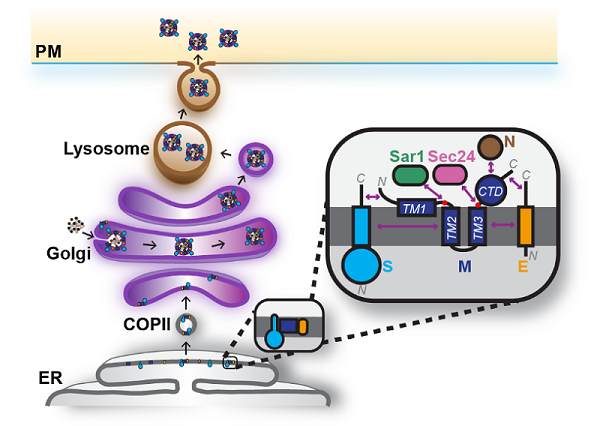
冠状病毒装配的工作模型
在病毒的装配过程中,M蛋白的正确朝向对募集S和E蛋白起到关键作用。此外,这三种蛋白单独表达时,仅有M蛋白主要富集于反式高尔基体,提示病毒的装配可能由M蛋白发起,并在高尔基体内进行。分析表明,M蛋白含有两个可与COPII组分直接结合的内质网输出信号以及一个与COPI结合的高尔基体滞留信号。当M蛋白无法正确定位或有效募集其他结构蛋白时,病毒装配将无法进行。这一装配机制在β属冠状病毒中呈现保守性。上述结果也表明干扰M蛋白的拓扑结构与膜转运过程可成为抑制冠状病毒装配的广谱策略。
中国科学院生物物理研究所的胡俊杰研究员为该论文的通讯作者,博士后吕蕊、博士生李凯莉(已毕业)、博士生项灵娇(已毕业)、武汉大学博士生李颖健(已毕业)为该论文的共同第一作者。中国科学院生物物理研究所邓红雨研究员和武汉大学陈宇教授团队也合作参与了该项工作。该工作得到了国家重点研发计划、基金委重点项目,以及中国科学院青年团队计划的资助。
文章链接:
https://doi.org/10.1016/j.scib.2025.06.012
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202507/t20250703_1046715.shtml
(供稿:胡俊杰研究组)
附件下载: