
“未雨绸缪”--朱冰研究组应邀综述细胞通过表观遗传调控未来基因表达的分子机制
在多细胞生命体中,尽管几乎所有细胞都拥有完全相同的DNA,但它们会对相同的信号做出截然不同的反应。过去的信号暴露经历甚至会影响细胞未来的应答模式。解答这些生命现象的关键在于表观遗传学。传统观点认为表观遗传学的主要功能是维持基因的开启或关闭状态,而近年来的前沿成果发现,细胞不仅能够维持现有的稳态,更会主动为未来的基因表达进行"准备"。这种准备并非直接开启基因,而是通过建立动态的"表观遗传屏障"(epigenetic barrier),来精确调控基因对未来信号的响应速度和强度。通过调控染色质结构、DNA甲基化和组蛋白修饰等手段,细胞能够为特定基因建立起一种可调控的响应状态,这种状态既能稳定地遗传给后代细胞,又保留了响应未来信号的灵活性,赋予了基因组在维持稳定性和可塑性之间的精妙平衡。
2025年6月16日,中国科学院生物物理研究所朱冰研究员和熊俊副研究员在《Annual Review of Genetics》杂志在线发表题为"Epigenetic Preparation of Future Gene Induction Kinetics"的综述文章,系统地阐述了细胞如何通过表观遗传机制"预设"基因表达状态,从而影响未来基因的激活效率和反应速度。该综述系统总结了四种核心的表观遗传准备机制(图1):(1)预激活(priming),细胞提前降低特定基因的"激活门槛",使其处于一种"蓄势待发"的状态,以便在接收到发育或环境信号时能够快速高效地开启;(2)预约束(reining),与"预激活"相反,这是一种"缰绳"机制,通过维持一个相对较高的激活屏障,帮助这些基因维持在"戒急缓发"的状态,防止过早或过度表达,从而确保基因表达的精确性和适度性;(3)转录记忆(transcriptional memory),细胞能够"记住"过去的基因激活事件,当再次遇到相同或相似的刺激时,拥有"记忆"的基因会以更快、更强的力度做出反应,这种机制是细胞适应反复出现的环境变化的关键;(4)转录耐受(transcriptional tolerance),在某些情况下,初次强烈的信号刺激反而会提高基因的激活屏障,导致其在后续刺激中反应减弱甚至沉默,这种负反馈机制对于防止如过度炎症反应等造成的组织损伤至关重要。
该综述进一步梳理了这些准备过程背后的分子机理,提出了一个完整的表观遗传准备的工作模型,围绕基因的选择性、"准备状态"跨越细胞分裂稳定继承的机制,以及细胞动态调控表观遗传屏障的关键策略等关键问题展开了深入讨论,并为未来的研究方向及发育异常、自身免疫性疾病和癌症的干预提供了全新的思路。
中国科学院生物物理研究所朱冰研究员和熊俊副研究员为本文的共同通讯作者。该工作得到国家自然科学基金委、中国科学技术协会和新基石研究员项目的支持。
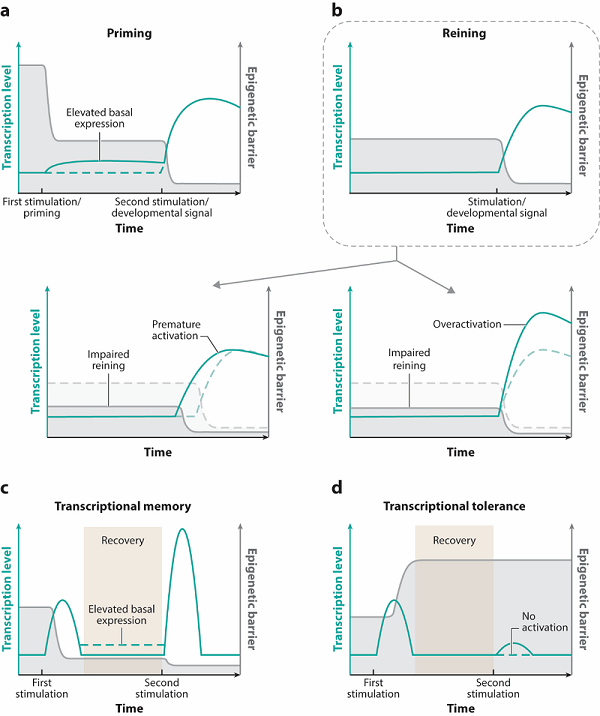
图1 :表观遗传准备机制的四种主要形式
文章链接:
https://doi.org/10.1146/annurev-genet-012825-093148
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202507/t20250701_1046535.shtml
(供稿:朱冰研究组)
附件下载: