
柳振峰研究组发现绿藻光系统II修复过程不同模块重新装配的原理
植物和藻类等光合生物可进行放氧型光合作用,在将光能转化为化学能的过程中裂解水并放出氧气和质子,为地球生物圈系统的能量与氧气提供主要来源。光系统II(photosystem II,PSII)是位于类囊体膜上的多亚基蛋白 色素复合物,在光能的驱动下通过催化水分子的氧化和质体醌的还原来参与光合电子传递过程。在植物和绿藻叶绿体中,成熟的PSII是由核心(core,C)复合物和外周捕光复合物II(light-harvesting complex II,LHCII)形成的PSII-LHCII超复合物(PSII-LHCII supercomplex,PSII-SC)。在光照下,PSII的核心亚基D1极易发生光损伤进而抑制PSII的活性,造成光合作用效率的下降,该现象在高光照条件下尤为显著。因此,光合生物演化出了名为PSII修复循环的机制,该过程主要包括PSII-SC的解组装、损伤D1蛋白的降解、新D1蛋白的合成和重新形成中间态复合物(反应中心-CP47,RC47复合物)、CP43模块与RC47重新组装形成PSII核心复合物(PSII-C)、PSII-C单体二聚化并与外周天线复合物组装形成PSII-SC。
研究组的前期工作揭示了PSII修复过程早期阶段的分子机制(Nat. Commun.,2024),而PSII修复中后期阶段中复合物重新组装过程的原理仍不明晰。前人的研究发现绿藻叶绿体中的TEF30 (Thylakoid Enriched Fraction 30)是一个与PSII修复有关的蛋白因子,其在高等植物中的同源蛋白名为MET1(Mesophyll Enriched Thylakoid protein 1)。生化研究结果表明TEF30可能参与PSII核心亚基CP43的重组装与PSII-SC的形成,但其发挥功能的分子基础尚不清楚。
2025年6月27日,中国科学院生物物理研究所生物大分子全国重点实验室柳振峰研究组在《Nature Plants》期刊上发表题为"Roles of multiple TEF30-associated intermediate complexes in the repair and reassembly of photosystem II in Chlamydomonas reinhardtii"的研究论文。该项工作结合抗体亲和纯化和蔗糖密度梯度超速离心的方法制备了结合有TEF30的PSII修复中间态复合物样品,并通过单颗粒冷冻电子显微学(single particle cryo-electron microscopy,cryo-EM)方法解析了4个含有TEF30的PSII中间态复合物的近原子分辨率结构(图1),分别命名为TEF30-C(结合一分子TEF30的PSII核心单体)、TEF302-C2-I(结合两分子TEF30的I型PSII核心二聚体)、TEF302-C2-II(结合两分子TEF30的II型PSII核心二聚体)和TEF30-C2S(结合一分子TEF30的C2S型PSII-SC,S代表紧密结合的捕光复合物LHCII三体)。
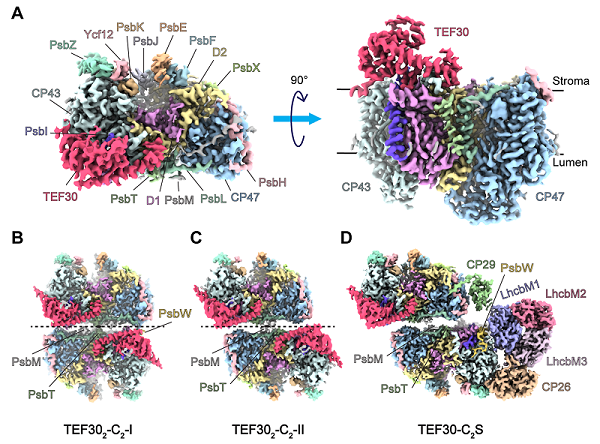
图1:4种不同TEF30-PSII复合物的冷冻电镜密度图。(A) 分辨率为2.98 Å的TEF30-C冷冻电镜密度图。左图为基质侧视图,右图为侧视图。(B) 分辨率为2.97 Å的TEF302-C2-I冷冻电镜密度的基质侧俯视图。(C) 分辨率为3.30Å的TEF302-C2-II冷冻电镜密度的基质侧俯视图。(D) 最高分辨率为2.90 Å的TEF30-C2S冷冻电镜密度的基质侧俯视图。
分析结果表明TEF30结合在PSII-C的基质侧表面,与PSII的核心亚基D1、D2、CP43和PsbI四个亚基形成了多对极性相互作用。生物膜干涉(biolayer interferometry,BLI)实验结果表明TEF30与PSII-C之间具有较高亲和力,解离常数KD为9.4 nM,截短TEF30与CP43或RC47相互作用的结构基序会大幅降低TEF30与PSII-C的相互作用。在TEF30-PSII复合物中,TEF30的结合位点横跨RC47与CP43模块的界面,该观察结果不仅与此前基于生化分析实验所提出的TEF30介导CP43重组装功能的研究结论相一致,而且直接确定了与TEF30相互作用的蛋白亚基和具体结合位点。
在TEF30-C2S中,仅一侧的PSII-C结合了TEF30,但未结合外周天线(LHCII、CP26和CP29),而对侧未结合TEF30的PSII-C旁结合了外周天线。TEF30-C2S与成熟C2S2型PSII-SC结构(PDB号:6KAC)的叠合比较结果显示TEF30与成熟C2S2中同侧的外周天线存在部分重叠。这种空间位阻效应可防止外周天线在PSII修复过程中过早地结合PSII-C,以保护尚不能进行能量转化的PSII-C免受过剩激发能的损伤。
此外,该研究通过对TEF302-C2-I、TEF302-C2-II、TEF30-C2S和成熟PSII-SC结构进行叠合比较,首次发现多个不同中间状态的PSII-C二聚体。结构分析提示PSII二聚体在重新组装和成熟的过程中,其中2个PSII-C单体的相对位置会发生显著的滑移和重排,从而在其两侧形成能够同时容纳LHCII、CP26和CP29三个外周天线复合物的锯齿状表面。
基于生物化学和冷冻电镜结构分析结果,该项研究提出了TEF30参与的PSII修复循环中后期不同模块重新装配形成成熟的PSII超复合物的工作机制模型(图2)。
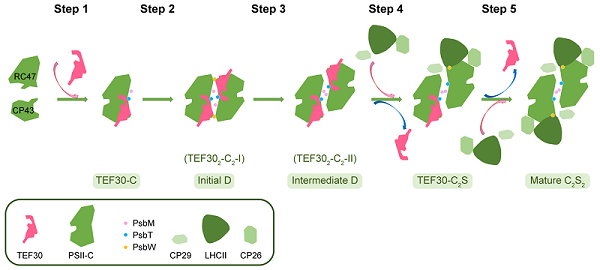
图2:TEF30参与的PSII修复中后期分子机制模型。图中展示的5个步骤分别为:(1)RC47和CP43模块在TEF30的介导下组装为TEF30-C。(2)TEF30-C二聚化形成TEF302-C2-I。(3)TEF302-C2-I中2个TEF30-C单体发生相对移动,形成TEF302-C2-II。(4)PSII-C单体间的位移继续进行,一侧的TEF30解离后外周天线结合,形成TEF30-C2S复合物。(5)另一侧的TEF30解离后外周天线与PSII核心结合,形成成熟的C2S2型超复合物。
中国科学院生物物理研究所生物大分子全国重点实验室柳振峰研究员为该论文的通讯作者。生物物理研究所研究生王伊迪博士(已毕业)为论文的第一作者,南开大学生命科学学院本科生王辰曦同学(现为清华大学生命科学联合中心研究生)和生物物理研究所研究生李安节博士(已毕业)参与了该工作。该项研究得到了国家自然科学基金委员会、中国科学院基础研究领域青年科学家项目和中国科学院战略性先导科技专项的资助和支持。冷冻电镜数据收集/荧光共聚焦显微镜观察、质谱分析、生物膜干涉实验分别得到了中国科学院生物物理研究所蛋白质科学研究平台生物成像中心、蛋白质组学技术实验室和结构与功能分析技术实验室工作人员们的帮助和支持;光合复合物功能表征相关实验得到了李梅课题组和中国科学院植物研究所平台的帮助和支持。该研究使用的pph1;pbcp突变体藻株来自于瑞士日内瓦大学Michel Goldschmidt-Clermont教授实验室。
论文链接:
https://doi.org/10.1038/s41477-025-02036-3
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202507/t20250707_1046911.shtml
(供稿:柳振峰研究组)
附件下载: