
娄继忠研究组与合作者揭示LAG-3顺式邻近激活机制和自免治疗新策略
免疫细胞,尤其是T细胞,在抗病毒感染和清除肿瘤中发挥着不可或缺的作用。然而,一旦调控失衡,这些强大的细胞也可能反过来攻击自身组织,诱发自身免疫性疾病。长期以来,T细胞相关的自身免疫治疗多依赖广谱免疫抑制策略,如糖皮质激素、JAK抑制剂、泛T细胞清除性抗体、以及阻断初始T细胞激活通路的CTLA-4-Fc融合蛋白等。这些方法往往缺乏细胞特异性,疗效有限,且常伴随感染风险和严重副作用。真正的挑战在于:如何精准识别并调控致病性T细胞,同时保留其他正常T细胞对机体防御至关重要的功能。这一问题正成为自身免疫治疗的核心方向和难点。
免疫检查点通路,特别是PD-1和LAG-3,在活化的T细胞诱导表达并精细负调其功能,从而在多种免疫疾病中均发挥关键作用。近年来,PD-1及其配体PD-L1的阻断抗体已广泛应用于肿瘤免疫治疗;同时,PD-1激动抗体也在自身免疫病中初现治疗潜力。LAG-3是另一经典的T细胞抑制性受体。有意思的是LAG-3虽然和PD-1都特异表达在肿瘤相关耗竭性T细胞表面,最近的研究表明LAG-3可以更特异地表达在自身免疫相关的致病性T细胞。尽管LAG-3阻断抗体Relatlimab已于2022年获批用于治疗黑色素瘤,其临床疗效仍相对有限,且高度依赖与PD-1抗体的联合使用。值得注意的是,LAG-3虽与PD-1几乎同期在三十多年前被发现,但其信号转导及配体调控机制仍是未解之谜,严重制约了该通路的基础研究与临床转化进展。因此,深入解析LAG-3的激活机制,对于突破当前免疫治疗瓶颈、推动新一代免疫治疗策略的研发至关重要。
2025年6月30日,娄继忠研究组与合作者在《Cell》期刊在线发表研究论文"Proximity between LAG-3 and the T Cell Receptor Guides Suppression of T Cell Activation and Autoimmunity"。该研究首次系统性揭示了LAG-3抑制受体由其经典配体MHC-II调控的条件性激活机制:LAG-3并非简单依赖配体结合本身,而是依赖MHC-II介导的TCR空间邻近效应,使LAG-3与TCR复合物形成顺式共定位并发生相分离,从而实现对CD4⁺ T细胞的有效抑制。该发现颠覆了人们对免疫检查点,特别是LAG-3激活机制的传统认知。LAG-3对激活条件的高度依赖性,意味着其在体内难以被有效触发;但这也为精准干预自身免疫性T细胞提供了独特机会。基于此机制,研究团队创新性地开发了靶向LAG-3与TCR的双特异T细胞抑制抗体(Bispecific T cell silencer,BiTS),可特异性调控LAG-3阳性的致病性T细胞,并在多种自身免疫病动物模型中展现出显著的治疗效果。
该研究提出"顺式共定位依赖性免疫检查点"的新概念,表明LAG-3并非传统意义上单纯依赖配体结合的受体,其功能调控依赖其在免疫突触中与TCR的空间距离。这种条件性机制一定程度上解释了LAG-3在癌症治疗中单药效果有限的原因,也为其在自身免疫疾病中富有潜力的应用提供理论支持。此外,该研究还提出了"顺式抑制双抗"的自身免疫治疗新策略,有望推动新一代靶向致病T细胞的精准免疫疗法开发,在自身免疫性疾病的治疗领域开辟新方向。
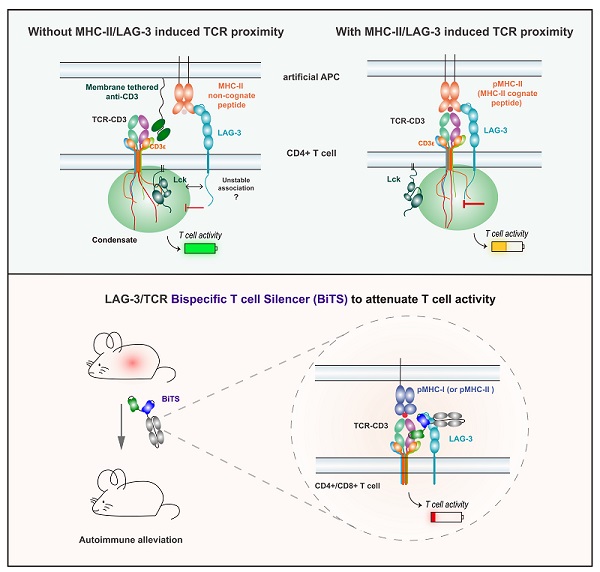
图:LAG-3可通过与TCR/CD3复合物的CD3e子链发生相分离而实现其抑制功能,利用LAG-3/TCR双特异性抗体增强LAG-3与TCR的顺式邻近有助于自身免疫疾病的治疗。
纽约大学格罗斯曼医学院王俊教授、中国科学院生物物理研究所娄继忠研究员和浙江大学医学院陈伟教授为论文共同通讯作者。王俊课题组博士生Jasper Du、研究科学家由佳博士,以及娄继忠课题组陈辉副研究员为论文共同第一作者。
文章链接:
https://www.cell.com/cell/fulltext/S0092-8674(25)00638-5
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202507/t20250703_1046716.shtml
(供稿:娄继忠研究组)
附件下载: