
王立堃研究组揭示锰离子通过过度激活IRE1α抑制肿瘤生长的新机制
肿瘤组织由于经受基因突变、缺氧、酸性等内在、外在环境因素的影响,细胞往往发生内质网(endoplasmic reticulum,ER)应激,这是一种由于未折叠或错误折叠蛋白在内质网腔内积聚而超过其蛋白处理能力的状态。在ER应激条件下,细胞会启动未折叠蛋白响应(unfolded protein response,UPR)以恢复内质网稳态。IRE1α(inositol-requiring enzyme 1α)是UPR中最为保守的信号通路之一,该通路在细胞存活中发挥着双重作用:一方面,其下游的XBP1剪接信号被广泛认为参与细胞对内质网应激的适应性响应,肿瘤细胞能利用此通路促进肿瘤生长和免疫逃逸,寻找和开发IRE1α抑制剂也因此成为肿瘤治疗的重要研究方向(见研究组前期研究工作DOI: 10.1016/j.cmet.2022.10.010)。另一方面,在严重或慢性ER应激条件下,IRE1α的持续和过度激活也可能通过RIDD(regulated IRE1α-dependent decay)和JNK信号通路引发细胞死亡。考虑到肿瘤细胞往往已有一定程度的IRE1α激活,进一步上调IRE1α的激活程度是否在抑制肿瘤生长中发挥积极作用是一个有趣的问题,但相关研究还很缺乏。
2025年7月15日,中国科学院生物物理研究所王立堃团队在《iScience》在线发表题为"Manganese suppresses tumor growth through hyper-activating IRE1α"的研究论文。该研究首次发现二价锰离子(Mn2+)可通过选择性过度激活内质网应激关键感应器IRE1α,引发下游促凋亡通路,进而抑制肿瘤生长,为癌症治疗提供了新思路。
研究团队发现,Mn2+能显著增强ER应激条件下IRE1α的磷酸化和聚合水平,激活RIDD和JNK等促凋亡通路,最终诱导乳腺癌细胞死亡。相比之下,其对IRE1α下游的适应性通路XBP1s的蛋白表达无明显促进,提示Mn2+具有促进"终末UPR"而非"适应性UPR"的偏向性作用。进一步体外实验证实Mn2+可直接结合IRE1α胞质结构域,提升其稳定性并增强激酶及RNase活性,为其生物效应提供分子基础。
在动物实验中,Mn2+的瘤内注射显著抑制乳腺癌原位移植肿瘤的生长,该作用在IRE1α缺失的肿瘤模型中完全丧失,证明其抗肿瘤效果依赖于IRE1α通路激活。此外,Mn2+注射后肿瘤组织中JNK磷酸化水平和细胞凋亡水平显著升高,而小鼠体重等指标未见明显异常,提示其具有一定的生物安全性。
该研究首次系统提出通过"激活"而非"抑制"IRE1α实现抗肿瘤的新策略,尤其适用于IRE1α本身高表达的肿瘤类型,拓展了UPR信号网络在肿瘤治疗中的应用边界。鉴于Mn2+作为磁共振成像增强剂等临床应用已有良好安全基础,未来有望进一步开发为靶向UPR通路的抗肿瘤候选药物。
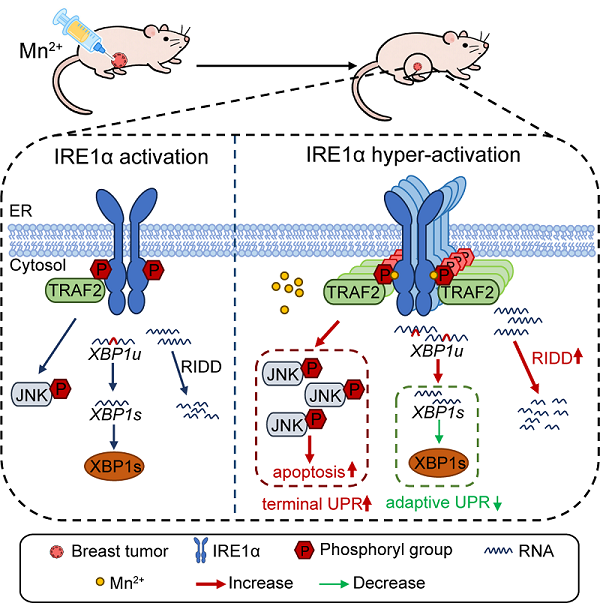
图. 锰过度激活IRE1α抑制肿瘤生长的机制示意图
中国科学院生物物理研究所王立堃研究员为该论文的通讯作者,博士生施若茜和已毕业博士王明为论文的共同第一作者。该研究受到国家自然科学基金、国家重点研发计划、中国科学院战略性先导科技专项、中国科学院青年交叉团队项目的资助。
文章链接:
https://www.cell.com/iscience/fulltext/S2589-0042(25)01382-3
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202508/t20250804_1048976.shtml
(供稿:王立堃研究组)
附件下载: