
徐平勇研究组在内源蛋白标记上取得重要进展
2025年8月29日,中国科学院生物物理研究所徐平勇研究组在《Nature Chemical Biology》期刊上发表了题为"ALFA nanobody-guided endogenous labeling"的研究论文。该研究开发了普适性强的内源蛋白标记技术ANGEL,突破性地解决了无荧光小肽基因敲入时无法进行高通量筛选的瓶颈。
人类基因组包含约2万个蛋白质编码基因,通过可变剪接和翻译后修饰等机制可产生超过100万种蛋白质变体。要深入理解这些蛋白质的功能及其调控机制,首先需要准确研究它们在细胞内的定位、表达水平和相互作用特征。目前常用的方法是通过融合荧光报告基因过表达目标蛋白,但这种方法存在局限性:一方面,超高分子量蛋白如核斑蛋白SON(264 kDa)或高GC重复序列编码的蛋白难以实现有效过表达;另一方面,过表达系统往往导致蛋白质水平远高于内源表达量,可能干扰细胞的正常生理功能。例如周期节律敏感性蛋白的表达水平受到严格的调控,以及内质网塑形蛋白CKAP4和RTN4的表达水平直接影响内质网形态和功能。因此,在天然遗传背景下研究目标蛋白的功能对生物学研究和应用至关重要。
将荧光蛋白等序列借助CRISPR基因编辑技术敲入基因位点,既可以观察目标蛋白的定位,又能保持其天然表达调控模式。然而,插入片段的大小是影响编辑效率的关键因素,较大的插入片段会导致编辑效率显著下降。为此,研究人员通常采用HA、FLAG等小肽标签对目标蛋白进行融合标记,一方面提高基因编辑效率,另一方面减少对目标蛋白的功能干预。但这些小肽标签自身不发荧光,获得成功基因敲入的单细胞克隆需要筛选和培养大量的克隆后通过PCR验证,费时费力。而且小肽标签往往需要依赖抗体染色,难以用于活细胞实时成像。
纳米抗体作为最小的功能性抗体片段,具有体积小(约15 kDa)、稳定性高和亲和力强等优势。荧光蛋白与纳米抗体融合形成的"荧光纳米抗体"(chromobody)不仅能实现多色活细胞标记,还可用于超分辨成像和蛋白质动态研究。然而,传统荧光纳米抗体需要针对每个目标蛋白单独开发,耗时费力。针对这一瓶颈,团队人员将目光转向通用型标记系统。ALFA标签是一种仅含13个氨基酸的理性设计标签,其稳定的α-螺旋结构使其体积小于大多数线性表位标签,且具有优异的化学稳定性。团队发现,与ALFA标签特异性结合的高亲和力纳米抗体NbALFA的稳定性依赖于ALFA标签的存在:在没有ALFA肽段时,NbALFA可部分被降解;而当细胞内ALFA标签水平升高时,NbALFA信号会相应增强。
基于这一特性,研究团队开发了小肽基因敲入可视化和快速筛选的创新技术,命名为ANGEL(ALFA Nanobody-guided endogenous labeling)。该技术首先对NbALFA进行定向进化改造,获得突变体mutNbALFA,该突变体在无ALFA标签时快速降解,而在ALFA标签存在时产生强荧光信号。这种"抗原稳定抗体"的特性使ALFA标签基因敲入细胞克隆能够通过荧光信号增强被高效识别。团队接着构建了NbALFA-荧光蛋白融合体整合到基因组中的稳定细胞系,确保在没有ALFA标签时NbALFA表达水平均一。随后利用CRISPR技术将ALFA标签精确敲入目标基因位点,通过检测NbALFA-荧光蛋白信号的变化来筛选成功编辑的细胞。
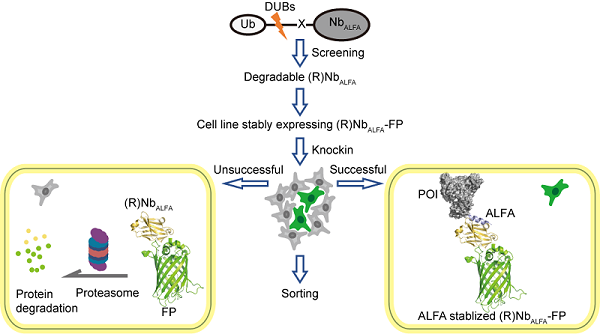
图 ANGEL流程示意图
ANGEL技术展现出卓越的适用性,成功内源标记了包括CKAP4、SEC61B、RTN4、Vimentin、核孔蛋白NUP96/NUP35、组蛋白H2BC21、CBX1、核纤层蛋白LMNA、肌动蛋白以及分子量高达264 kDa的核斑核心蛋白SON在内的多种蛋白质。值得注意的是,无论目标蛋白的GC含量如何变化或表达丰度高低,ANGEL都能实现精准标记。对于SON等超大蛋白,通过串联ALFA标签也实现了有效标记。此外,与分裂荧光蛋白标记策略不同,利用PiggyBac转座子系统可在建立ALFA标签细胞系后完全去除mutNbALFA,获得无残留背景的纯净细胞系。重要的是,研究团队在天然细胞环境中利用标签同步实现了精准内源蛋白标记、串联标签信号放大、蛋白动态实时示踪、靶向降解诱导及蛋白互作网络解析五大功能整合。通过对核斑点关键蛋白SON的ANGEL标记,研究团队在活细胞中实时动态跟踪了内源核散斑的运动和形态变化,揭示了有丝分裂中的内源核斑点的时空运动规律。
ANGEL技术可扩展到其它小肽的内源蛋白标记,高效地将一个或多个小肽标签写入基因组特定位点。通过荧光纳米抗体实现内源蛋白的多色标记,不仅适用于不同组织深度的成像需求,还能兼容多种成像模式。更重要的是,ANGEL为研究内源蛋白的生物学功能提供了实时、可靠的"一站式"平台,克服了传统过表达系统的局限性,为蛋白质功能研究和药物开发开辟了新途径。该技术的广泛应用将极大推动我们对蛋白质动态调控网络的理解,为精准医学研究提供强有力的工具。
中国科学院生物物理研究所袁琳副研究员和徐平勇研究员为该文章的共同通讯作者。该工作受到国家重点研发计划、国家自然科学基金以及中国科学院战略性先导科技专项等项目的资助。
文章链接:
https://www.nature.com/articles/s41589-025-02019-7
(供稿:徐平勇研究组)
附件下载: