
李伟研究组与合作者揭示
H3.3丝氨酸31位点的磷酸化为转录过程中核小体动力学的分子开关
核小体核心颗粒(NCP)是真核生物染色质的基本单位,由组蛋白八聚体缠绕147 bp DNA形成左手超螺旋结构,作为DNA加工机制的主要物理屏障,在几乎所有DNA相关生物过程中起关键作用。组蛋白变体H3.3与经典H3.2存在四个氨基酸差异,其中N端尾部的丝氨酸31(Ser31)可发生磷酸化修饰(H3.3S31ph)。研究表明,H3.3S31ph通过排斥ZMYND11、招募SETD2和p300等机制,动态调控核小体状态与FACT复合物结合,从而在巨噬细胞免疫应答、胚胎干细胞分化及早期胚胎发育中驱动快速转录重编程。这一修饰作为分子开关,能将H3.3核小体从稳定状态转化为动态活化构型,为理解表观遗传调控提供了新机制见解。然而,H3.3影响核小体稳定性和动态性的具体机制尚不明确。
2025年9月12日,中国科学院生物物理研究所李伟研究员和首都医科大学基础医学院陈萍教授带领团队在《Nucleic Acids Research》期刊上发表题为"Phosphorylation of H3.3 at Serine 31 acts as a switch of nucleosome dynamics for transcription"的研究论文。该研究首次为H3.3及其Ser31磷酸化如何调控核小体动态性和转录应答提供了新机制见解,并确定这一机制对巨噬细胞免疫应答通路的研究发挥重要作用。
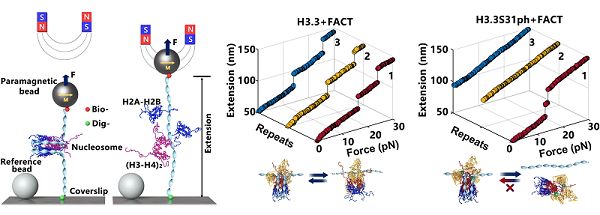
图1. 利用高分辨磁镊单分子操控技术,精确表征FACT与H3.3核小体的互作。
核小体动态结构的精确表征是确定变体H3.3作用的关键一步。研究人员首先通过利用体外核小体组装体系,结合自主建立的高时空分辨单核小体磁镊操控技术,深入解析了H3.3和FACT对核小体稳定性及结构动力学过程的影响(图1)。该研究表明,虽然H3.3不会显著改变核小体的稳定性,但能增强核小体完整性的维持。值得注意的是,与经典H3相比,H3.3能更高效地招募FACT复合物,从而抵消FACT核小体的作用。FACT与H3.3核小体的结合会进一步稳定核小体结构,而这一效应可被H3.3第31位丝氨酸磷酸化(H3.3S31ph)逆转。通过全基因组分析,研究人员发现H3.3的沉积及其Ser31位点磷酸化能动态调控核小体状态,影响FACT结合,并调节巨噬细胞在刺激条件下的转录应答。H3.3S31位点的选择性磷酸化作为一个关键分子开关,使H3.3核小体从稳定的维持状态转变为动态的活跃构型。该分子开关使细胞能够快速响应环境刺激,从而促进转录激活(图2)。
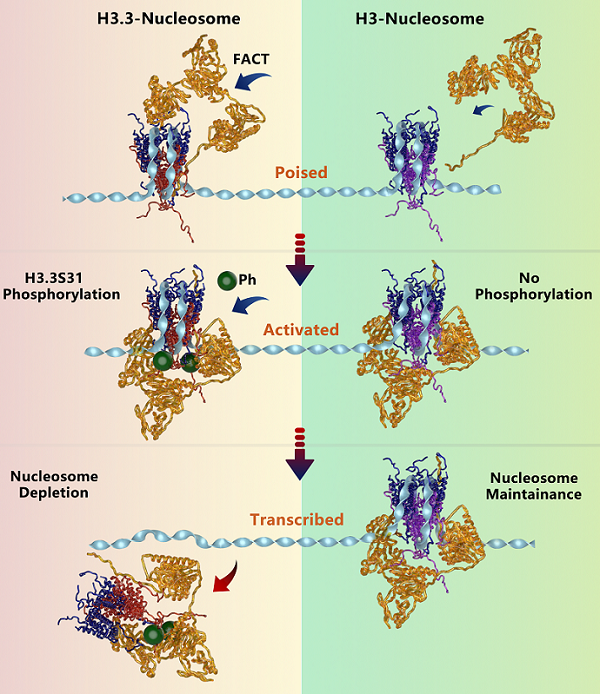
图2. H3.3S31磷酸化可充当分子开关,调控核小体从稳定状态向活化状态的动态转变。
该研究结合多种技术手段,揭示了组蛋白变体H3.3如何通过其独特的磷酸化修饰与FACT复合物动态协同调控巨噬细胞激活的分子机制,且发现H3.3S31ph与FACT复合物的协同作用,在响应环境信号调控染色质状态中发挥核心作用。这些发现将为开发靶向治疗策略提供重要参考,通过调控H3.3磷酸化和FACT功能通路,治疗染色质功能异常相关疾病(如炎症性疾病和癌症)。
中国科学院生物物理研究所李伟研究员、首都医科大学基础医学院陈萍教授、武汉大学生命科学学院的李国红教授和生物物理研究所余娟副研究员为论文的共同通讯作者,中国科学院生物物理研究所肖雪博士、首都医科大学基础医学院博士生马静哲博士和张钧然博士为共同第一作者。该研究受到国家自然科学基金重大项目、面上基金、中国科学院战略性先导科技专项和国家重点研发计划的资助。
文章链接:
https://academic.oup.com/nar/article/53/17/gkaf891/8252030
院英文网报道链接:
https://english.cas.cn/newsroom/research_news/life/202509/t20250926_1055733.shtml
(供稿:李伟研究组)
附件下载: