
徐平勇研究组在红色光稳定荧光蛋白的开发方面取得重要进展
在活细胞超分辨率荧光显微技术领域,受激发射损耗显微成像技术(STED)和结构光照明显微成像技术(SIM)等方法通过突破光学衍射极限,为细胞生物学研究提供了纳米尺度的分辨能力。然而,这些技术实现超高分辨率的同时,也对其核心成像工具--荧光蛋白的光稳定性提出了严峻挑战。STED显微镜为实现纳米级分辨率所必需的高功率损耗激光,会显著加速荧光蛋白的光漂白过程,导致信号快速衰减,使得长时程成像尤其是三维(3D)结构重建变得困难。同样,SIM技术特别是3D-SIM,需要对每个焦平面采集多幅图像进行重建,这一过程对荧光蛋白在反复光照下保持信号稳定的能力要求极高。目前,虽然绿色荧光蛋白变体如mStayGold等在光稳定性方面取得了显著进展,但在光谱的红色区域,能够同时满足高亮度与高光稳定性要求的红色荧光蛋白仍然稀缺,这直接限制了活细胞长时程超分辨及多色超分辨成像。
2025年11月26日,中国科学院生物物理研究所徐平勇研究组在《Nature Methods》发表题为"A highly photostable monomeric red fluorescent protein for dual-color 3D STED and time-lapse 3D SIM imaging"的研究论文。针对上述技术瓶颈,研究团队以亮度极高的红色荧光蛋白mScarlet3为模板,展开了系统性的蛋白质工程改造。这一过程始于对关键位点的理性设计--团队成员受到mScarletH通过第163位点突变显著提高稳定性的启发,在mScarlet3中引入了相应的突变,获得了mScarlet3-H变体。虽然该变体的光稳定性有少许提升,但经过严格测试,其改善程度仍无法满足STED和SIM等超分辨成像的要求。这一结果促使研究团队进一步深入探索,推测单一突变可能不足以解决复杂的光漂白问题。因此,团队成员搭建了光稳定性半自动化筛选平台,并在mScarlet3-H的基础上,对其周围的关键氨基酸进行了系统性的突变筛选,特别针对易于发生氧化的氨基酸残基。通过多轮组合优化,开发出了一系列具有增强光稳定性的红色荧光蛋白变体,其中性质最优的命名为mScarlet3-S2。
经过严格表征,mScarlet3-S2表现出比其模板mScarlet3高出29倍的光稳定性,这一指标也远远超过了目前已知的其他红色荧光蛋白。这种显著的光稳定性提升,使得利用STED和SIM技术进行长时间的二维及三维超分辨率成像成为可能。在技术验证中,成功实现了超过150层的三维STED成像,而mScarlet3-H和mScarlet-H分别只能实现10层和2层的成像深度。
基于mScarlet3-S2的高光稳定性,团队成员将其应用于内质网与核膜互作结构的研究中。通过3D STED超分辨率成像,获得了内质网结构前所未有的细节信息,揭示了许多先前未被观察到的超微结构特征。这些发现包括内质网内陷至细胞核中形成中空、沙漏状的核质网结构、非平面的内质网四岔连接结构、核膜的内陷现象,以及内质网-核膜接触位点的三维分布图谱。空间分析进一步表明,这些接触位点沿核膜呈现非随机的极化分布模式,并存在包括点状、带状和分支状在内的多种形态类型。这些观察结果丰富了研究人员对内质网膜拓扑复杂性的认识,对现有细胞器连接模型提供了重要的结构学补充。
该项工作的创新性在于成功解决了红色荧光蛋白在超分辨率成像应用中光稳定性不足的核心问题。mScarlet3-S2的开发不仅为活细胞长时程超分辨率成像提供了可靠的红色荧光标记工具,还通过其在STED和SIM成像中的卓越表现,拓展了研究人员对亚细胞结构复杂性的认识边界。这一进展将促进细胞生物学多个研究领域的发展,特别是在细胞器动态相互作用、膜接触位点功能以及细胞内运输等过程的长时程、高分辨率观测方面具有广泛应用前景。随着mScarlet3-S2在科学研究中的广泛应用,预期将在活细胞超分辨率成像领域获得更多前所未有的生物学发现。
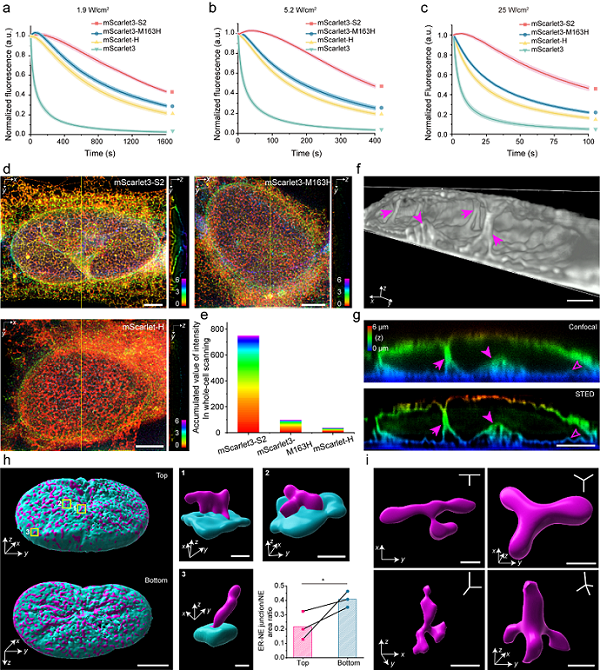
图. a-c.不同能量密度条件下,mScarlet3-S2的光稳定性. d-e. 不同RFP标记的内质网的3D-STED成像结果. f-g.内质网内陷至细胞核中的核质网结构. h. 内质网与核膜互作位点分布图. i.内质网平面及非平面的三向及四向连接结构.
中国科学院生物物理研究所徐平勇研究员和袁琳副研究员为该论文的共同通讯作者。该工作获得北京大学陈良怡教授、陈知行教授以及南开大学潘雷霆教授等人的大力支持与帮助。该工作受到国家重点研发计划、国家自然科学基金以及中国科学院战略性先导科技专项等项目的资助。
文章链接:
https://www.nature.com/articles/s41592-025-02962-2
(供稿:徐平勇研究组)
附件下载: