
生物物理所团队开发出纳米级三维各向同性超分辨显微镜
12月2日,生物物理所徐涛院士课题组与纪伟课题组在《Nature Methods》上发表题为"Molecular-scale Isotropic 3D Super-Resolution Microscopy via Interference Localization"的研究论文,团队研制出三维干涉定位显微镜(ROSE-3D),首次在单分子定位成像领域,实现了基于相机的纳米尺度三维各向同性分辨率。
这是该团队在发展的干涉定位显微镜ROSE(Nature Methods 2019)和ROSE-Z(Nature Methods 2021)基础上,在干涉定位显微镜领域的又一新突破。通过设计基于光电偏转器的高速切换照明光路,ROSE-3D成功在X、Y、Z三个方向同时引入干涉光,并实现了小于1微秒的干涉条纹切换时间。
传统的基于图形质心定位的单分子定位显微镜,各方向分辨率有较大差异。同时三维样本中离焦单分子成像光斑变大,也会导致分辨率的大幅下降。ROSE-3D通过三维干涉定位,摆脱了对单分子形状的依赖,在约一微米的景深范围内,可将横向定位精度提升2-6倍,轴向定位精度提升3.5-8倍。凭借卓越的三维解析能力,ROSE-3D单层成像就能够对细胞内1微米厚度的结构实现纳米分辨率的解析。
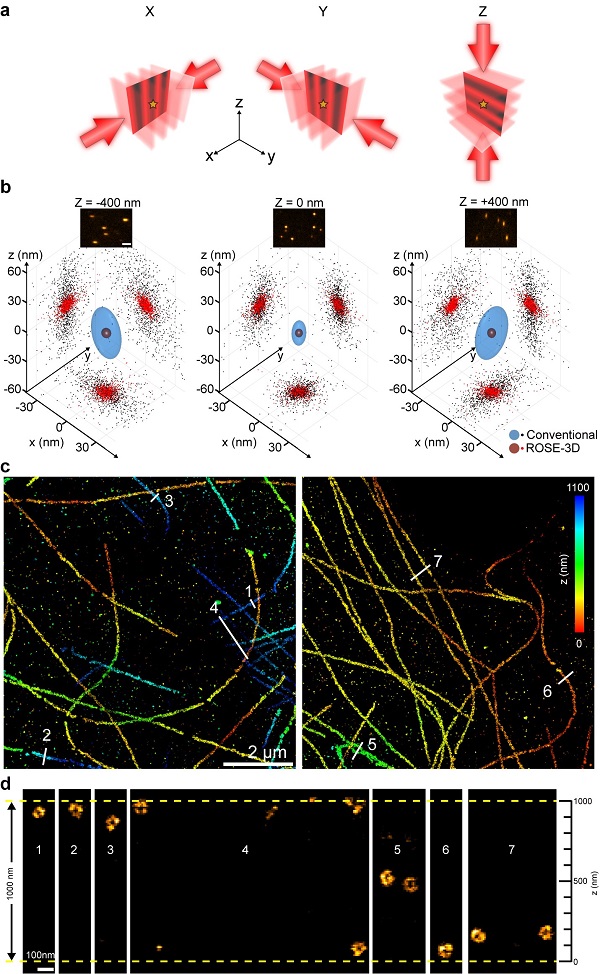
图1. ROSE-3D的工作原理及对微管中空结构的解析
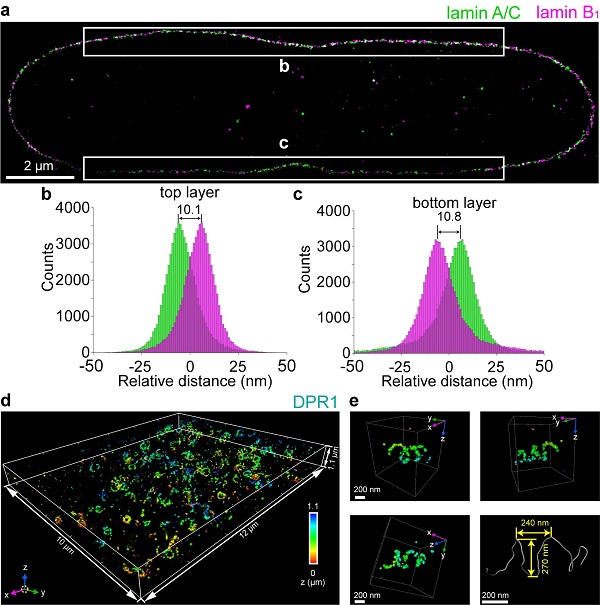
图2. ROSE-3D对全细胞核纤层蛋白及DPR1复合物结构的解析
该工作还拓展了ROSE-3D的多色与多层成像功能,实现了对COS-7细胞中核纤层蛋白lamin A/C与lamin B1的双色成像。统计分析显示,lamin A/C分布于lamin B1内侧,两者间距约10纳米,这是首次从三维全细胞核尺度揭示该分布的特征。此外,利用三维各向同性纳米分辨能力,研究团队还捕捉到了线粒体分裂关键蛋白DPR1组成的复合体在线粒体外膜组装成螺旋状、环状等多种形态,这也是首次在原位实现对该蛋白复合物的结构解析。
该工作表明,ROSE-3D作为一项全新的三维多色纳米分辨率成像技术,能够以超高分辨率实现对亚细胞器结构以及生物大分子复合物的精准定位与组装分析,为细胞原位三维纳米结构的研究提供了强有力的技术支持。该技术突破了传统光学超分辨成像分辨率各向异性的瓶颈,成功克服了成像方向和深度上的不均一性难题,首次实现了分子尺度的三维各向同性超分辨率成像。ROSE-3D在解析生物样品内各种三维纳米结构,以及揭示生物大分子的原位组装机制等方面具有重要意义。目前,该技术已在怀柔科学城成功实现落地转化,助力高端科学仪器国产化。
徐涛院士、纪伟研究员和谷陆生正高工是该论文的共同通讯作者,博士后罗世行、博士生赵先傲、副研究员李媛媛和副研究员樊春燕为共同第一作者。该工作受到国家自然科学基金委、国家重点研发计划、中国科学院战略性先导科技专项(B类)、中国科学院稳定支持基础研究领域青年团队计划、科技创新2030重大项目以及北京市科委等的资助。
文章链接:
https://www.nature.com/articles/s41592-025-02911-z
(供稿:徐涛研究组、纪伟研究组)
附件下载: