
冯巍研究组揭示驱动蛋白kinesin-2的组装机制
在生物体里,每一个细胞都是一个高度有序而繁忙的"微型城市"。而驱动蛋白(kinesin)就是这座城市中负责运输的重要"快递员"。它们沿着细胞内部的"公路"--微管(microtubules)移动,把各种"包裹"如蛋白质、细胞器、囊泡等,精准地送到细胞的不同位置。绝大多数驱动蛋白家族成员,如 kinesin-1和kinesin-3,通常由两个相同的马达亚基组成,形成同源二聚体以完成细胞内的定向运输功能。与此不同,kinesin-2代表了一类特殊的驱动蛋白,它组装为异源二聚体,由两种不同的马达亚基(如 KIF3A /KIF3B 或 KIF3A/KIF3C)结合形成。此外,经典的 kinesin-2还包括一个非马达亚基 KAP3,构成稳定的异三聚体结构。这种异源组装方式不仅赋予kinesin-2更复杂的货物识别能力,也使其在纤毛顺向运输等特化功能中发挥着不可替代的作用。然而,kinesin-2异源三聚体的组装方式尚未明确。KIF3A、KIF3B等基因突变已被发现与多种遗传性纤毛病相关,包括视网膜色素变性、多囊肾和神经发育障碍等。因此,系统研究kinesin-2的组装调控不仅有助于揭示纤毛相关疾病的发病机制,也为靶向干预和基因治疗提供了潜在方向。
2025年7月24日,中国科学院生物物理研究所冯巍研究组在《Nature Communications》上发表了一篇题为"A mutual co-recognition mechanism ensures the proper assembly of heterotrimeric kinesin-2 for intraflagellar transport"的研究论文。该研究围绕秀丽隐杆线虫来源的kinesin-2异源三聚体(由KLP-11、KLP-20和KAP-1三个亚基组成),开展了一项涵盖结构解析与功能验证的系统性研究,重点揭示了其组装过程中的相互共识别机制,并在体内验证了该机制的生理学意义。
研究首先通过体外共表达的方式重组了kinesin-2 异源三聚体复合物,并利用单颗粒冷冻电镜对其整体构型进行了三维重构。低分辨率的重构结果显示,KAP-1具有典型的Armadillo重复结构,其中央区域形成一条底物结合槽,可能用于识别并结合两个马达亚基的尾部区域。基于该结构信息,研究进一步优化了蛋白构建方案,通过删除部分柔性片段,设计并构建出一个保留其核心结构的简化复合体,用于X-射线晶体学研究,最终获得了3.5 Å分辨率的晶体结构。
该结构显示,两个马达尾部通过各自高度保守的异源配对触发序列(HTS)缠绕形成异源二聚体,并协同捕获KAP-1的羧基端钩状结构(CTH-hook);同时,两个马达尾部还深度嵌入KAP-1的中央凹槽,形成多个特异性结合界面。这一结构清晰揭示了三亚基之间的相互共识别及其协同配对机制,构成了一种高度特异且稳定的复合物组装模式。
为验证关键结构作用界面的功能重要性,研究团队设计并构建了一系列作用界面的突变体,通过免疫共沉淀实验来评估复合体的组装能力,从而确认了其对kinesin-2异源三聚体组装的重要作用。进一步地,研究者在秀丽隐杆线虫感觉神经元的纤毛中表达这些突变体,并结合荧光标记的IFT蛋白进行体内成像,分析其在纤毛中的运输行为。结果表明,破坏关键作用界面显著抑制了KAP-1进入纤毛的能力,并影响了纤毛内顺向运输过程,进一步验证了该相互共识别机制在维持纤毛内物质运输功能中的关键作用。
值得注意的是,kinesin-2异源三聚体复合物的作用界面区域含有多个潜在的磷酸化位点,这些位点的磷酸化可能会破坏关键界面的稳定性,诱导异源三聚体的解离。因此暗示kinesin-2异源三聚体的组装与解离可能受到磷酸化的调控,从而介导其在纤毛内物质运输过程中动态的装配与解离循环。
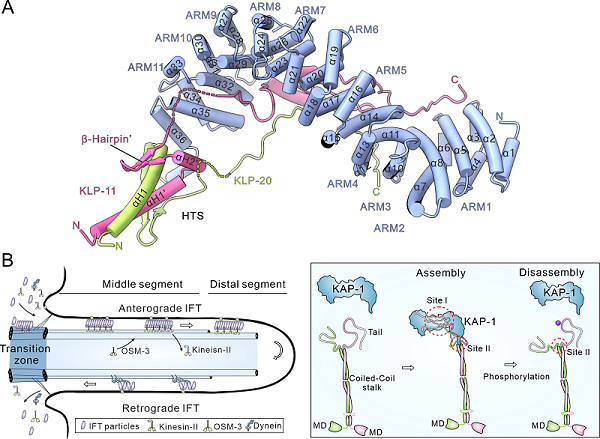
图. 驱动蛋白kinesin-2异源三聚体尾部区域的整体结构及其参与纤毛内物质运输调控的模式图
中国科学院生物物理研究所冯巍研究员为该论文的通讯作者,冯巍课题组副研究员任锦启博士,生物物理研究所与中科大联培博士生赵玲艳以及清华大学博士生陈广涵为论文的共同第一作者,清华大学欧光朔教授也为该研究贡献了力量。该研究得到中国科学院稳定支持基础研究领域青年团队计划、科技创新2030脑科学与类脑研究重大项目、北京市自然科学基金以及中国科学院青年创新促进会的资助。
文章链接: https://doi.org/10.1038/s41467-025-62152-8
(供稿:冯巍研究组)
附件下载: